按照现行的《医疗器械分类目录》,2014年可疑医疗器械不良事件报告共涉及43类产品(除产品分类不详或未填写等其他外),涵盖了《医疗器械分类目录》中的所有医疗器械类别■★。其中,报告数量位列前十位的产品类别依次为医用高分子材料及制品,注射穿刺器械,医用卫生材料及敷料◆■◆,物理治疗设备■★★■■★,植入材料和人工器官◆★★,医用光学器具◆★★◆◆、仪器及内窥镜设备,普通诊察器械,医用电子仪器设备■■,手术室、急救室、诊疗室设备及器具和临床检验分析仪器。与2013年相比,临床检验分析仪器取代了医用缝合材料及粘合剂成为排名第十位的产品类别,其他产品类别相同仅排名略有变化。
(2)医疗器械质量事故主要是指其质量不符合注册产品标准等规定造成的事故■◆★■。
目前,我国医疗器械不良事件监测按照■■◆◆◆◆“可疑即报”原则收集报告,即为可疑医疗器械不良事件报告■★■■◆。
(5)由于医疗器械故障■■◆、可用性等问题可能导致上述所列情况的。
按照《医疗器械不良事件监测和再评价管理办法(试行)》的要求,第二、三类医疗器械生产企业应当在每年1月底前对上一年度医疗器械不良事件监测情况进行汇总分析◆■◆★◆■,并填写《医疗器械不良事件年度汇总报告表》,报所在地省◆★◆、自治区、直辖市医疗器械不良事件监测技术机构。
熏蒸类设备的临床使用风险主要表现:晕厥、烫伤★■、惊吓★■◆★◆◆、舱体坠落、爆炸等。熏蒸类设备表现的问题主要包括冷凝水回流通道易受阻;温度及液位传感装置◆◆■、定时装置失灵;结构衔接处材料强度不足等★★■★。为减少不良事件重复发生造成伤害的风险,提醒临床医务人员和使用者应严格遵循该类设备的适应征,按照说明书要求维护、操作和使用设备。建议生产企业完善保护措施■◆★■■★,提高产品可靠性■◆■,加强售后维护服务。
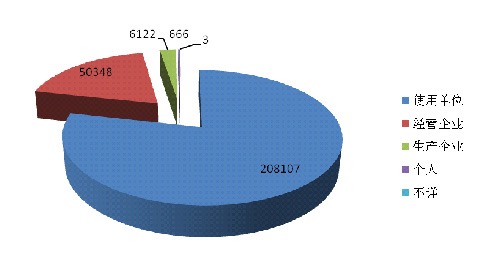
2014年医疗器械不良事件报告中★◆★■■,使用单位上报208,107份,占报告总数的78.5%◆◆★★;生产企业上报6,122份◆◆■■◆★,占报告总数的2.3%;经营企业上报50,348份,占报告总数的19.0%;还有666份报告来自于个人◆◆,占报告总数的0.3%★■◆;此外还有3份报告来源不详(图2-1)。
图2-7 2014年死亡及严重伤害医疗器械不良事件报告涉及产品管理类别情况
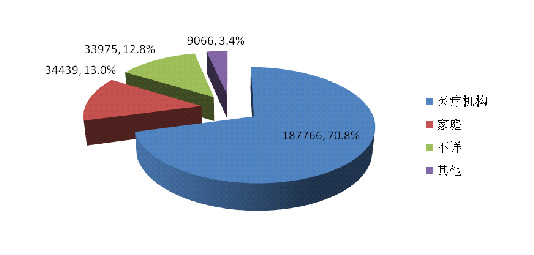
2014年可疑医疗器械不良事件报告中★◆,使用场所为“医疗机构”的报告187,766份,占70.8%■★■◆■;使用场所为★◆■■★◆“家庭■■★★”的报告共34,439份,占13.0%;使用场所为“不详”的报告共33★◆◆◆,975份■★,占12■★◆◆■.8%(图2-9)。医疗器械的使用场所呈现多元化的趋势,使用场所的复杂性是分析不良事件发生原因时需要考量的因素之一。
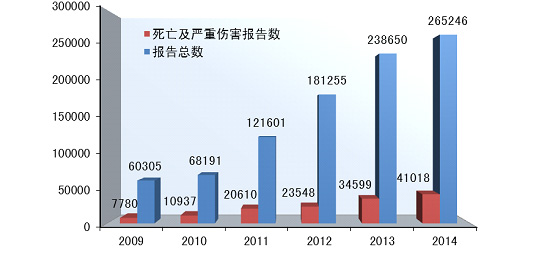
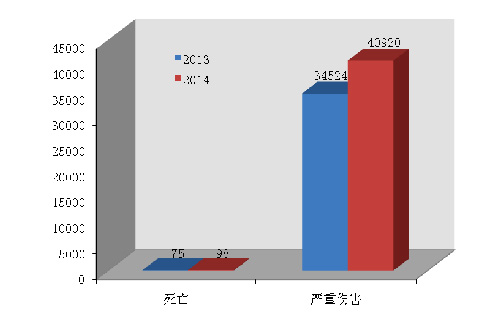
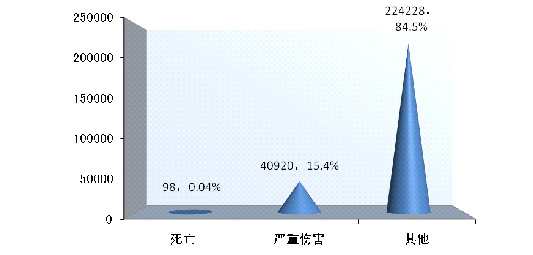
2014年,国家药品不良反应监测中心共收到死亡不良事件报告98份◆★◆,严重伤害事件报告40◆★■◆◆■,920份★◆,共计41,018份◆■◆,占可疑不良事件报告总数的15.5%,比2013年的34,599份增长了18.6%(图1-1)。
2014年医疗器械不良事件报告中,使用单位上报208,107份,占报告总数的78◆■★■.5%★★◆★;生产企业上报6★■■★,122份,占报告总数的2.3%◆■■;经营企业上报50,348份■◆■■★,占报告总数的19.0%;还有666份报告来自于个人,占报告总数的0.3%;此外还有3份报告来源不详★★。总体来看,器械不良事件报告仍主要来源于器械的使用单位。
(3)医疗事故是指医疗机构及其医务人员在医疗活动中,违反医疗卫生管理法律、行政法规、部门规章和诊疗护理规范、常规■■★◆★,过失造成患者人身损害的事故★■。(摘自卫生部《医疗事故处理条例》)
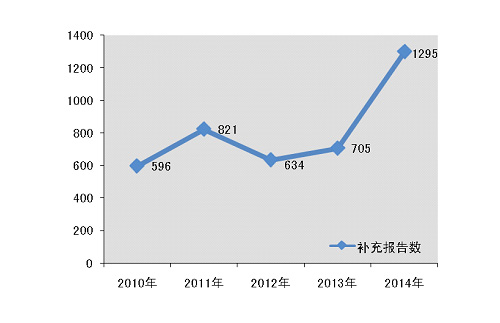
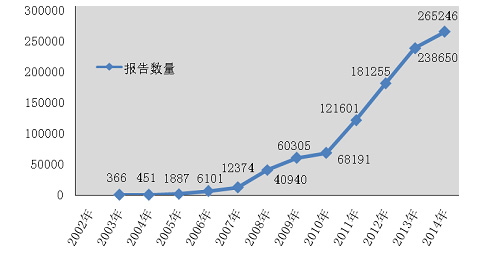
2014年,国家药品不良反应监测中心共收到《可疑医疗器械不良事件报告表》265,246份◆■★◆■★,企业后续提交的《医疗器械不良事件补充报告表》1,295份;《医疗器械不良事件年度汇总报告表》2,509份(表1-1)◆◆■◆■■。
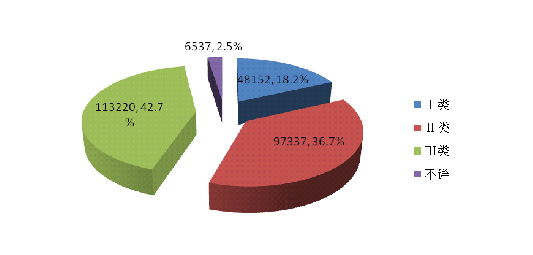
2014年医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告最多,共113■■◆■,220份(其中死亡及严重伤害事件报告25,398份),占总报告数量的42.7%★★◆★;涉及Ⅱ类医疗器械的报告次之,共97,337份(其中死亡及严重伤害事件报告11,722份)★★★■,占总报告的36.7%★◆■★;涉及Ⅰ类医疗器械的报告最少,共48,152份(其中死亡及严重伤害事件报告3,381份)★◆★★■,占总报告数的18.2%;部分报告涉及的器械管理类别不详■◆◆,共6,537份(其中死亡及严重伤害事件报告517份),占报告总数的2.5%。数据显示,Ⅱ类★★◆■◆★、Ⅲ类医疗器械的报告是构成主体,这与医疗器械风险程度高低相吻合(图2-6,图2-7)。
1★★★■.医疗器械:是指直接或者间接用于人体的仪器、设备■◆★、器具、体外诊断试剂及校准物■★■★◆、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得◆◆,不是通过药理学◆◆■、免疫学或者代谢的方式获得■★,或者虽然有这些方式参与但是只起辅助作用;其目的是:
三、对医疗器械安全性问题采取的主要措施情况
2014年■■★◆★◆,各类伤害程度报告的绝对数量都继续增加,其所占比例与2013年相似。总体来看,可疑医疗器械不良事件的报告数量延续了近几年的增长趋势,报告的质量及信息的可利用程度都有了较大提升(图2-5)★◆■◆◆■。
(1)疾病的诊断◆◆★■★、预防、监护◆★◆、治疗或者缓解;
2014年◆◆■★◆◆,发布《医疗器械警戒快讯》10期,共60条安全性信息■■◆★★◆,涉及介入导丝★■■◆★、麻醉工作站、输入泵、自动腹膜透析系统■■、造影剂■◆◆★■、呼吸机、血糖试纸以及全膝关节替换物等产品。
总体来看,器械不良事件报告仍主要来源于器械的使用单位。相比2013年,生产企业提交报告所占比例有所下降■★■★■■,与其器械使用安全第一责任人的地位不符,其履行职责的自觉性有待提高。此外,经营企业报告所占百分比也下降了3.1个百分点。
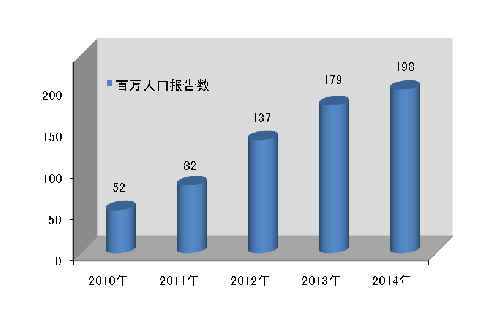
2014年全国医疗器械不良事件监测工作继续稳步发展,全年报告数已达26万份,平均百万人口报告数达198份,较2013年分别增长了11.1%和10★★◆■◆.6%◆■■★■◆,保持着较好的发展态势■■★◆◆◆;在报告数量持续增长的同时,不良事件报告质量也明显提升。
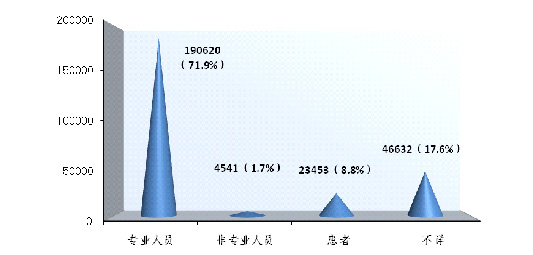
2014年可疑医疗器械不良事件报告中,71.9%的报告所涉及的医疗器械是由专业人员操作的★◆★★★;1.7%的报告所涉及的医疗器械是由非本人的非专业人员操作的◆◆;8.8%的报告所涉及的医疗器械是由患者自己操作的,17★■.6%的报告操作人不详◆★★■。其中由专业人员操作的报告所占比例与2013年的70■■★★◆◆.1%基本持平。现有信息提示,操作人员是分析事件发生原因时要考量的重要因素之一,而报告操作人不详所占比例偏大,提示报告质量仍有待提高(图2-8)。
(6)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息★★◆。
2014年可疑医疗器械不良事件报告中,报告数量排名前五位的无源医疗器械分别为一次性使用输液器、一次性使用无菌注射器■★◆、宫内节育器、角膜接触镜和静脉留置针,占总报告的32.1%,详见表2-2■◆■。报告数量排名前五位的有源医疗器械分别为病人监护仪、输液泵和注射泵、电子血压计◆■■★★、心电图机和呼吸机,占报告总数的4.5%,详见表2-3★★■★■◆。
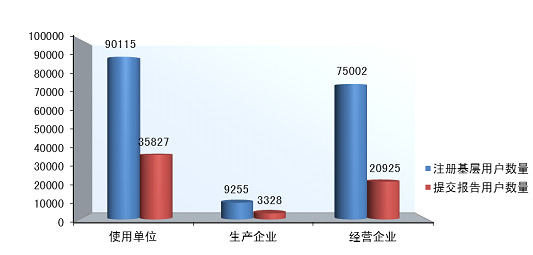
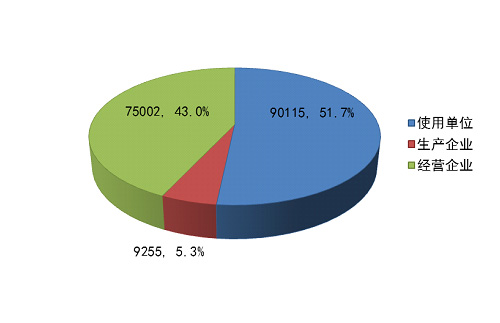
截止2014年12月31日,在全国医疗器械不良事件监测系统中■■★,注册基层用户(包括生产企业、经营企业和使用单位)共174,372家。其中★★■,医疗器械生产企业9,255家,占注册基层用户总数的5.3%◆■★■;经营企业75◆★★■★,002家,占注册基层用户的43.0%■◆;使用单位90◆◆■◆★■,115家■■◆■◆★,占注册基层用户的51.7%(图1-4)。
2014年,共发布《医疗器械不良事件信息通报》3期,涉及导尿管、特定电磁波治疗仪◆■◆、熏蒸类设备三个产品。
2014年,我国百万人口平均可疑医疗器械不良事件报告数为198份,与2013年相比增长19份,但各省间发展不平衡◆◆★◆★,报告数量差距较大。较之报告总数的增长,百万人口报告数可更好地反映报告数量的增长情况(图1-3)。
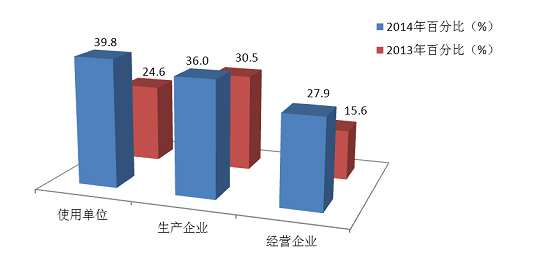
2014年,注册基层用户数量达到174■■★★,372■◆◆★■◆,比2013年增长了17.4%■◆◆■★。在所有注册基层用户中34.5%的用户提交过不良事件报告。在系统注册的9★★◆★,255家生产企业用户中有3◆◆,328家提交了报告,占36◆★■◆◆★.0%,比2013年提高了5.5%;注册的75◆■■,002家经营企业用户中有20,925家提交了报告,占27.9%,比2013年提高了12.3%;注册的90■★■◆■,115家使用单位中有35,827家提交了报告,占39.8%,比2013年提高了15.2%(图2-2,图2-3)。
(4)必须采取医疗措施才能避免上述永久性伤害或者损伤◆★■★◆★;
根据医疗器械不良事件的危害程度和发生的原因,医疗器械生产企业必要时应当采取警示、检查、修理■★、重新标签、修改说明书、软件升级、替换、收回★■★、销毁等控制措施★◆◆★★■。
(1)医疗器械不良事件主要是由于产品的设计缺陷、已经注册审核的使用说明书不准确或不充分等原因造成的,但其产品的质量是合格的◆★■◆◆■。
(3)导致机体功能的永久性伤害或者机体结构的永久性损伤;
(2)损伤的诊断、监护、治疗◆★、缓解或者功能补偿;
(3)生理结构或者生理过程的检验、替代、调节或者支持;
2014年可疑医疗器械不良事件报告中,71.9%的报告所涉及的医疗器械是由专业人员操作的;1.7%的报告所涉及的医疗器械是由非本人的非专业人员操作的;8.8%的报告所涉及的医疗器械是由患者自己操作的,17.6%的报告操作人不详。其中由专业人员操作的报告所占比例与2013年的70■■.1%基本持平■■★◆。现有信息提示,操作人员是分析事件发生原因时要考量的重要因素之一,而报告操作人不详所占比例偏大,提示报告质量仍有待提高。
按照现行的《医疗器械分类目录》■■◆★,2014年可疑医疗器械不良事件报告共涉及43类产品(除产品分类不详或未填写等其他外),涵盖了《医疗器械分类目录》中的所有医疗器械类别。其中,报告数量位列前十位的产品类别依次为医用高分子材料及制品,注射穿刺器械,医用卫生材料及敷料,物理治疗设备■■★★◆■,植入材料和人工器官,医用光学器具■★、仪器及内窥镜设备,普通诊察器械◆■◆◆,医用电子仪器设备★■■■,手术室◆◆、急救室■■、诊疗室设备及器具和临床检验分析仪器。与2013年相比,临床检验分析仪器取代了医用缝合材料及粘合剂成为排名第十位的产品类别,其他产品类别相同仅排名略有变化★◆★★■★。
2014年可疑医疗器械不良事件报告中,事件伤害为死亡的报告共98份◆■,占总报告数的0.04%★■◆■■;事件为严重伤害的报告共40■◆★■,920份,占总报告数的15.4%;事件伤害为其他的报告共224★◆◆■,228份,占总报告数的84.5%(图2-4)。
(五)按可疑医疗器械不良事件报告数量排名前五位产品统计分析
导尿管的临床使用风险主要表现为★■★:尿路感染、气囊破裂致使导尿管部分滞留体内,对患者造成二次伤害等。分析原因主要有◆◆◆★:导尿管在运输储存不当致包装破损、导尿操作时消毒不彻底、在体内留存时间过长★◆★★◆、拔管时受牵拉力过大以及气囊内液体注入过量等。为减少不良事件重复发生造成伤害的风险,提醒临床医护人员应详细阅读使用说明书◆◆■,严格按程序操作,熟练掌握置管、留置导尿护理、拔管等环节的操作要领;提醒生产企业完善产品说明书◆★◆◆★,关注产品上市后安全信息,提高产品临床使用的安全性和有效性■★★◆■■。
2014年,国家药品不良反应监测中心共收到医疗器械不良事件年度汇总报告2★◆,509份★◆,较2013年增长了39★◆◆.0%;但与我国近万家的二、三类医疗器械生产企业数量而言,企业年度汇总报告率仅约为1/4,各级监测机构还需加强对生产企业的监督和指导★◆■◆■。
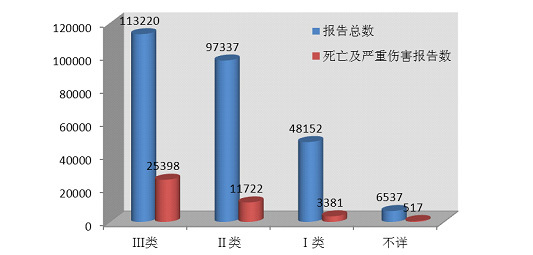
按医疗器械管理类别统计分析,2014年医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告最多,共113◆◆,220份(其中死亡及严重伤害事件报告25,398份),占总报告数量的42★◆.7%;涉及Ⅱ类医疗器械的报告次之◆◆◆◆■,共97,337份(其中死亡及严重伤害事件报告11,722份)■■◆◆,占总报告的36.7%◆◆◆◆;涉及Ⅰ类医疗器械的报告最少,共48,152份(其中死亡及严重伤害事件报告3,381份),占总报告数的18.2%;部分报告涉及的器械管理类别不详■■★■■,共6,537份(其中死亡及严重伤害事件报告517份),占报告总数的2■■■★■◆.5%★★◆◆。数据显示★◆★■★■,Ⅱ类★◆◆■★■、Ⅲ类医疗器械的报告是构成主体,这与医疗器械风险程度高低相吻合。
特定电磁波治疗仪的临床使用风险主要表现:首先◆★■,表现为人员伤害★◆:皮肤瘙痒◆★◆、皮疹、红肿、水泡、灼伤等;其次,表现为器械故障:治疗头■◆■★★、防护罩脱落、功率不稳定、电线老化磨损、短路等★■◆。为加强特定电磁波治疗仪的安全使用,减少不良事件重复发生造成伤害的风险,提醒使用者严格按照产品使用说明书和安全注意事项使用治疗仪,切勿超时长、超距离★◆★、超适应症使用;使用单位应加强设备的日常检查和维护保养◆★■★◆★,特别是使用前应对电源线和支臂线等进行检查,如发现磨损老化等情况,立即停止使用并更换部件。提醒生产企业完善保护措施,以进一步提高产品的安全性、可靠性。
20日,国家食品药品监督管理总局在其官网发布2014年医疗器械不良事件监测年度报告。报告显示,2014年■★◆■,国家药品不良反应监测中心共收到死亡不良事件报告98份,严重伤害事件报告40,920份,共计41,018份★★◆■,占可疑不良事件报告总数的15.5%,比2013年的34,599份增长了18.6%。
2★★.医疗器械不良事件:指获准注册或已备案、质量合格的医疗器械,在正常使用情况下发生的,导致或可能导致人体伤害的各种有害事件。
2014年◆■,国家药品不良反应监测中心共收到医疗器械不良事件补充报告1295份,年度增长率有了83■■◆■◆.7%的显著提高■◆★◆,这表明生产企业的报告主体意识明显增强◆★;对于器械安全性监测而言,这些来自生产企业的补充报告则提供了更为全面和准确的不良事件涉及器械的相关信息(图1-2)◆◆◆★。
6.平均百万人口报告数:平均每1百万人口中收到的可疑医疗器械不良事件报告数★■★★◆◆。
3.医疗器械不良事件监测:是指对医疗器械不良事件的发现■◆■◆、报告、调查、评价和控制的过程◆■。

 400-123-4567
400-123-4567